Incyte公司近日宣布,歐洲藥品管理局(EMA)已受理ruxolitinib(蘆可替尼)乳膏劑,這是一款非甾體、抗炎、外用JAK抑制劑,用于成人和青少年(年齡>12歲)患者,治療面部受累的非節段型白癜風(vitiligo)。EMA即將啟動MAA的正式審查程序。如果獲得批準,ruxolitinib乳膏劑將成為第一個也是唯一一個用于治療白癜風進行皮損復色(repigmentation)的藥物。
ruxolitinib乳膏劑是Incyte公司選擇性Janus激酶1和Janus激酶2(JAK1/JAK2)抑制劑ruxolitinib的專利配方制劑,專為局部應用而設計。Incyte擁有開發和商業化ruxolitinib乳膏劑的全球權利。目前,ruxolitinib乳膏劑正處于3期臨床開發:(1)用于治療輕度至中度特應性皮炎(TRuE-AD項目);(2)用于治療青少年和成人白癜風(TRuE-V項目)。
2021年9月,美國FDA批準Opzelura(ruxolitinib乳膏劑),用于短期和非持續性慢性治療接受外用處方療法未能充分控制病情或當這些療法不可取、非免疫功能低下的輕度至中度特應性皮炎(AD)青少年(年齡≥12歲)和成人患者。
值得一提的是,Opzelura是美國FDA批準的第一個也是唯一一個外用JAK抑制劑。研究表明,JAK-STAT通路的失調導致了AD的關鍵特征,如瘙癢、炎癥、皮膚屏障功能障礙。在3期臨床研究中,Opzelura治療顯著減少了與AD相關的皮膚炎癥和瘙癢。而減少瘙癢可潛在地改善AD患者的關鍵疾病相關和生活質量結果。
白癜風是一種慢性自身免疫性疾病,其特征是皮膚色素脫失,這是由產色素細胞——黑素細胞(melanocyte)丟失引起的一種皮膚病,常影響美容美觀。白癜風影響全球約0.5%-2.0%的人口,目前還沒有美國FDA或歐盟EMA批準治療白癜風的藥物療法。該病可發生在任何年齡,雖然許多白癜風患者會在20歲之前經歷初步癥狀。
ruxolitinib乳膏劑治療白癜風的MAA,基于關鍵3期TRuE-V臨床試驗項目的結果。數據顯示,該項目中2項3期臨床研究均達到主要終點和關鍵次要終點:治療24周后,與賦形劑乳膏劑治療組相比,ruxolitinib乳膏劑治療組患者面部和全身皮損復色有顯著改善。該項目中,ruxolitinib乳膏劑用藥24周沒有報告臨床上顯著的用藥部位反應,總體安全性良好。(具體結果詳見:EADV 2021: Incyte Presentations)
Incyte執行副總裁、歐洲總經理Jonathan Dickinson表示:“EMA對ruxolitinib乳膏劑MAA的受理,標志著白癜風患者群體的一個重要里程碑,對他們來說,日常生活通常會受到重大影響,目前治療選擇很有限。我們致力于傾聽患者群體的意見,以了解我們如何幫助滿足未滿足的需求,并支持醫療保健提供者更好地管理這一具有挑戰性的疾病。我們期待著與監管機構合作,以期盡快將這一新的潛在療法帶給符合資格的患者。”
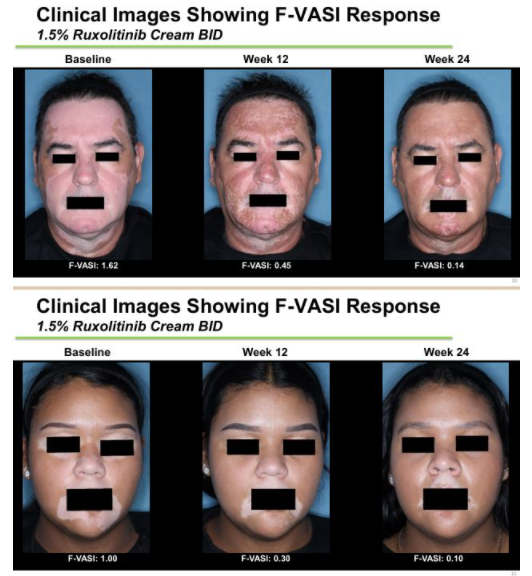
Opzelura(ruxolitinib乳膏劑)治療24周效果
TRuE-V項目包括2項3期研究TRuE-V1(NCT04052425)和TRuE-V2(NCT04057573),在青少年和成人(≥12歲)白癜風患者中開展,每項研究入組了大約300例診斷為非節段型白癜風(non-segmental vitiligo,NSV)且有色素脫失區域的患者,目的是評估ruxolitinib乳膏劑作為單藥療法的療效和安全性。研究中,患者被隨機分為2組,接受1.5% ruxolitinib乳膏劑每日2次(BID)或賦形劑對照乳膏劑BID,進行為期24周的雙盲期治療。成功完成基線檢查和第24周評估的患者,包括在雙盲期接受賦形劑對照乳膏劑的患者,進入擴展期,給予1.5% ruxolitinib乳膏劑BID治療28周。
結果顯示,TRuE-V1和TRuE-V2均達到了主要終點(2項研究均p<0.0001):數據顯示,在治療第24周,與賦形劑對照乳膏劑BID治療組相比,1.5% ruxolitinib乳膏劑BID治療組有顯著更高比例的患者實現面部白癜風區域評分指數(F-VASI)較基線改善≥75%(F-VASI75)。
此外,這2項研究也達到了關鍵次要終點,包括:第24周F-VASI較基線改善的百分比,第24周達到F-VASI50(較基線改善≥50%)、F-VASI90(較基線改善≥90%)、全身白癜風區域評分指數(T-VASI)較基線改善≥50%(T-VASI50)的患者比例,第24周達到白癜風顯著性量表(VNS)得分為4分(不那么引人注目)或5分(不再引人注目)的患者比例,患者報告結果。ruxolitinib乳膏劑的總體療效和安全性與之前報道的2期研究數據一致,沒有觀察到新的安全信號。2項研究的長期療效和安全性部分將按計劃繼續進行。
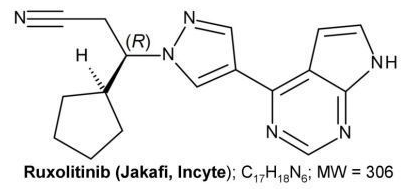
ruxolitinib是Incyte公司口服藥物Jakafi的活性藥物成分,該藥在美國已批準3個適應癥:(1)治療對巰基尿應答不足或不耐受的的紅細胞增多癥(PV)成人患者;(2)治療中高危骨髓纖維化(MF)成人患者,包括原發性MF、PV后MF、原發性血小板增多癥后MF;(3)治療類固醇難治性急性移植物抗宿主病(GVHD)患者。其中,第三個適應癥于2019年5月獲FDA批準,是首個獲批治療個適應癥的藥物。Jakafi由Incyte在美國銷售,諾華在美國以外市場以Jakavi品牌名銷售。
目前,Concert公司也正在開發采用氘化學技術修飾的ruxolitinib分子——CTP-543,在II期臨床研究中,治療斑禿展現出強勁療效。斑禿是一種自身免疫性疾病,導致局部或完全脫發。ruxolitinib的氘化學修飾可以改變其人體藥代動力學,從而增強其作為斑禿治療的用途。在美國,FDA已授予CTP-543治療斑禿的快速通道地位。
來源:https://news.bioon.com/article/6792358.html